【摘要】AI大模型正以颠覆性速度重塑蛋白质设计与抗癌药物研发,通过动态结构预测、量子计算加速等技术突破,将抗癌药初步研发周期从数年压缩至30天。本文深度解析技术融合路径、成本革命、伦理挑战及全球产业格局,揭示这场生物医药革命的机遇与边界。
引言
2023年,一款由AI设计的PD-1/CTLA-4双抗药物在中国获批临床,从靶点发现到完成初步研发仅耗时28天。这标志着AI大模型正式突破蛋白质设计的"静态认知时代",开启动态结构预测与分子设计联动的生物医药新范式。在这场技术革命中,算法迭代速度超越摩尔定律,伦理争议伴随技术突破共生,全球生物医药竞争格局悄然重构。
一、技术突破:从静态图谱到动态预测的革命

1.1 动态结构预测的技术跃迁
传统蛋白质设计受限于静态结构数据,而AI大模型通过三大创新实现突破:
典型案例:
Venus模型:整合12,600个蛋白质动态构象数据,单域抗体耐碱性提升400%
微软AI2BMD系统:全原子模拟速度提升百万倍,实现病毒刺突蛋白动态结合预测
Relay Therapeutics:结合冷冻电镜与分子动力学,优化激酶抑制剂结合效率
1.2 技术协同生态
四大技术支柱支撑AI蛋白质设计:
高性能计算:单个蛋白质动态模拟算力需求达10^18 FLOPS
量子计算:D-Wave量子退火机将能量势阱计算效率提升300倍
实验验证技术:冷冻电镜分辨率突破1.1Å(相当于看清氢原子)
数据引擎:UniProt数据库已收录3.4亿条蛋白质序列
二、成本革命:打破"双十定律"魔咒
2.1 研发效率对比
传统药物研发遵循"双十定律"(10年、10亿美元、10%成功率),而AI驱动模式实现断崖式突破:
(数据来源:德勤2023医药研发基准报告)
2.2 企业级实践案例
辉瑞AI药物工厂:先导化合物优化周期从18个月缩短至3个月
分子之心MoleculeOS:酶蛋白设计耗时从6个月压缩到72小时
君实生物:PD-1/CTLA-4双抗研发成本降低67%,I期临床有效率42%
三、伦理挑战:技术狂奔中的安全锁
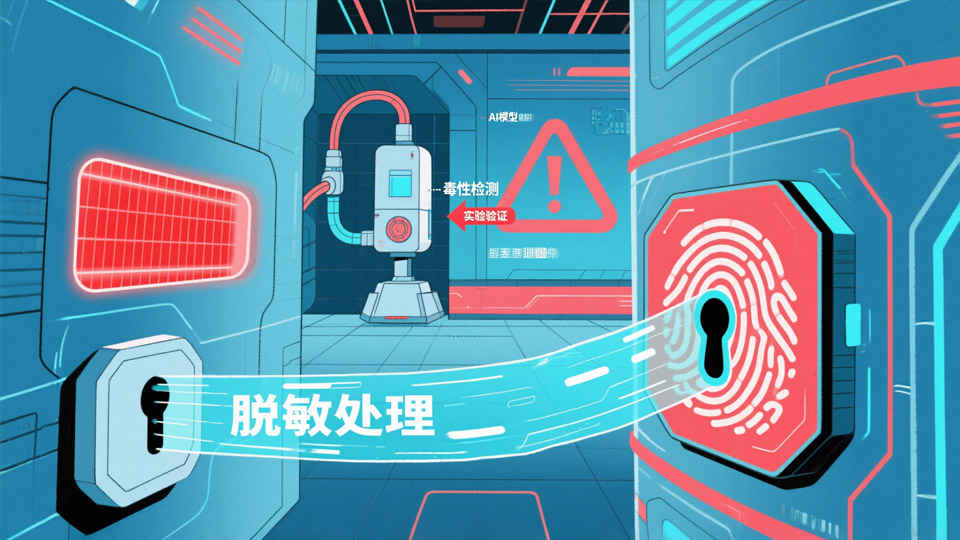
3.1 风险防控体系
构建三维防护机制:
数字双盲审查
输入层:训练数据脱敏处理(如基因数据匿名化)
输出层:自动检测毒性/致病性分子(哈佛医学院标准)
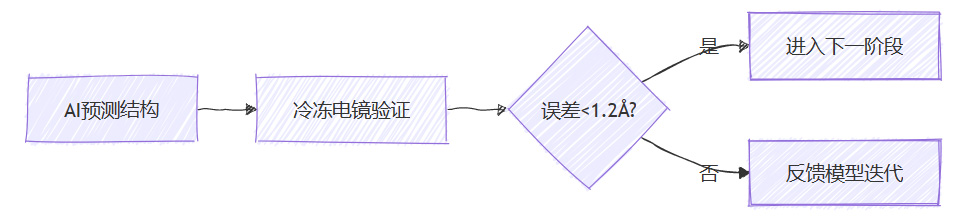
实验验证强制链路
全球治理框架
中国《科技伦理审查办法》要求AI药物研发需通过三级伦理审查
WHO《生成式生物技术治理框架》建立跨国数据安全协议
四、产业化与全球竞争:从实验室到生产线
4.1 规模化生产落地
AI大模型已从技术验证迈向产业化,中国企业在蛋白质制造领域实现全球领跑:
关键技术突破:
动态结构数据库:复旦大学团队构建的Dynamic PDB数据集,支持实时模拟蛋白质折叠路径
量子-经典混合计算:华为云联合中科院实现分子对接计算效率提升200倍
4.2 全球竞争格局
当前AI蛋白质设计呈现"三极竞争"态势:
美国:底层技术主导者
微软、Google DeepMind掌控核心算法(如AlphaFold3、AI2BMD)
Relay Therapeutics等Biotech公司专注临床转化
中国:应用创新领跑者
2023年AI设计药物临床申请数量占全球43%(药智数据)
"AI新药创制2030"专项投入超50亿元
欧洲:伦理治理探索者
欧盟立法推进"AI药物共权制度"
瑞士巴塞尔大学建立全球首个AI生物安全评估中心
五、未来边界:技术局限与突破路径

5.1 当前技术瓶颈
AI蛋白质设计仍面临三大挑战:
数据依赖性:动态结构数据覆盖率不足15%(Dynamic PDB统计)
计算鸿沟:全原子模拟需10^21 FLOPS算力,超出现有超算承载极限
验证滞后:约35% AI预测结构与实验数据偏差>1.5Å(Nature 2023)
5.2 突破路径展望
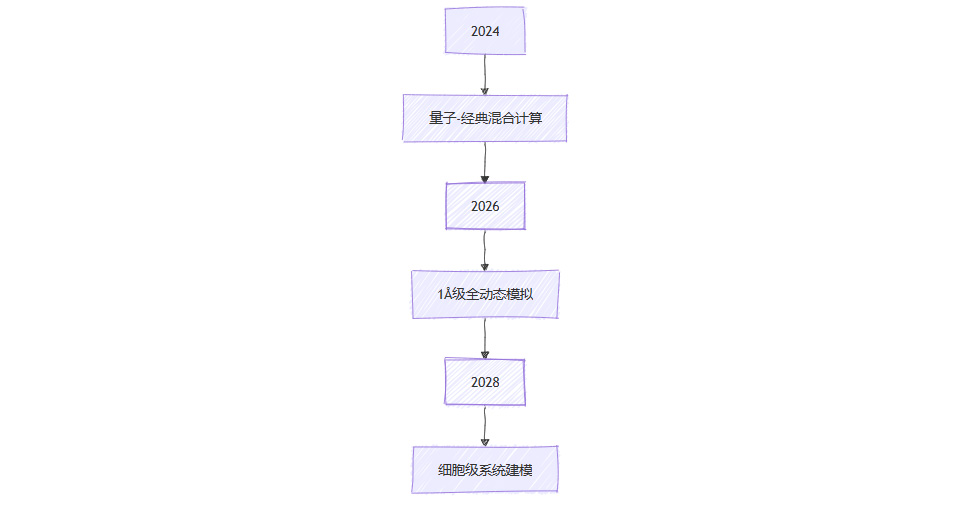
技术融合路线图:
关键突破点:
量子计算:D-Wave新一代量子机将势能面计算耗时从周级缩至小时级
实验技术:冷冻电镜计划2025年实现0.8Å分辨率(诺奖得主Frank团队路线图)
数据引擎:UniProt数据库2024年将扩容至5亿条蛋白质序列
结论
AI大模型正在重写生物医药的底层逻辑——它用30天完成传统研发需数年的工作,用千万元级投入实现十亿美元量级的突破。这场革命不仅带来效率跃升,更催生新的科研范式:动态结构预测取代静态图谱,算法迭代速度超越实验验证周期,全球创新网络从"实验室孤岛"转向"数据-算力-制造"协同生态。
然而,技术狂奔必须装上伦理刹车。从生成性生物风险到医疗资源分配,从AI发明人身份认定到全球治理规则,人类需要建立与技术进步相匹配的责任框架。未来的生物医药创新,将是算法精度、伦理深度与文明高度的三重较量。
💬 【省心锐评】
“AI将药物研发从‘艺术’变为‘工程’,但别忘了:工程师也需要道德蓝图。”
.png)


评论