【摘要】多模态大模型正深刻重构医疗诊断流程,通过跨文本、影像、基因等多源数据的深度融合,实现全病程智能预测与个性化医疗。本文系统梳理了CLIP等多模态对齐技术在医学领域的创新应用、技术机制、产业落地、挑战与未来趋势,全面展现了多模态大模型驱动下医疗智能化的广阔前景。
引言
近年来,人工智能(AI)与医疗健康的深度融合,正推动医疗诊断迈向智能化、精准化、全流程化的新纪元。尤其是多模态大模型(Multi-modal Large Models, MMLMs)的崛起,打破了传统单一模态分析的局限,将文本、医学影像、基因组等多源异构数据深度整合,为疾病的早期筛查、精准诊断、个体化治疗和全病程预测提供了前所未有的技术支撑。以CLIP(Contrastive Language-Image Pre-training)为代表的多模态对齐架构,成为实现医学数据深度融合的关键引擎。本文将系统梳理多模态大模型在医疗诊断领域的创新应用、技术机制、产业落地、面临的挑战与未来趋势,全面展现其在重构医疗诊断流程中的深远影响。
一、🌐多模态大模型的崛起与医疗诊断变革

1.1 多模态大模型的技术基础
1.1.1 多模态数据的定义与特征
多模态数据指的是来源、类型、结构各异的多源信息,主要包括:
文本数据:如电子病历、医生报告、患者主诉、实验室检查结果等结构化与非结构化文本。
医学影像:包括X光、CT、MRI、超声、PET等多种医学影像数据。
基因组数据:如全基因组测序、单细胞测序、分子分型等高维生物信息。
生理参数与可穿戴设备数据:心电、血压、血糖、运动等连续监测数据。
这些数据类型在信息表达、时空分布、结构复杂度等方面高度异构,传统AI模型难以实现有效融合与协同分析。
1.1.2 多模态大模型的核心架构
多模态大模型通过深度神经网络(如Transformer、CNN、RNN等)实现对不同模态数据的特征提取、对齐与融合。以CLIP为代表的对比学习架构,通过大规模图像-文本对的联合训练,将不同模态数据映射到同一语义空间,实现跨模态的语义理解与推理。近年来,随着算力提升和数据积累,多模态大模型在参数规模、泛化能力、任务适应性等方面取得突破,成为医疗智能化的核心驱动力。
1.2 医疗诊断的多模态智能化转型
1.2.1 传统医疗诊断的局限
单一模态分析:传统诊断多依赖单一数据源(如影像或文本),信息利用率低,难以全面反映患者病情。
主观性强:医生经验和主观判断影响诊断一致性,尤其在复杂或罕见病例中误诊、漏诊风险高。
数据孤岛:不同科室、设备、机构间数据难以互通,阻碍了全病程管理和智能化分析。
1.2.2 多模态大模型带来的变革
数据深度融合:实现文本、影像、基因等多源数据的协同分析,提升诊断的全面性和准确性。
智能辅助决策:AI模型自动提取关键特征,辅助医生进行疾病筛查、分型、预后预测等多环节决策。
全病程智能管理:支持从早期筛查、诊断、治疗到随访的全流程闭环管理,推动个性化医疗落地。
二、🚀多模态对齐技术的创新应用
2.1 跨模态对齐与联合分析
2.1.1 CLIP架构的核心机制
CLIP通过对比学习,将医学影像与文本报告映射到同一语义空间,实现影像与文本的自动对齐、检索和辅助诊断。其Zero-shot能力使得模型无需针对特定疾病标注即可进行初步筛查,极大提升了模型的泛化能力和应用灵活性。
2.1.2 典型应用场景
影像-文本自动检索:医生可通过自然语言描述快速检索相关病例影像,提升临床效率。
辅助诊断与筛查:在乳腺癌、肺结节等疾病分类任务中,多模态对齐模型准确率较传统方法提升15%以上。
多模态病例库构建:支持大规模病例影像与文本的自动配对与归档,便于科研与教学。
2.1.3 应用流程图
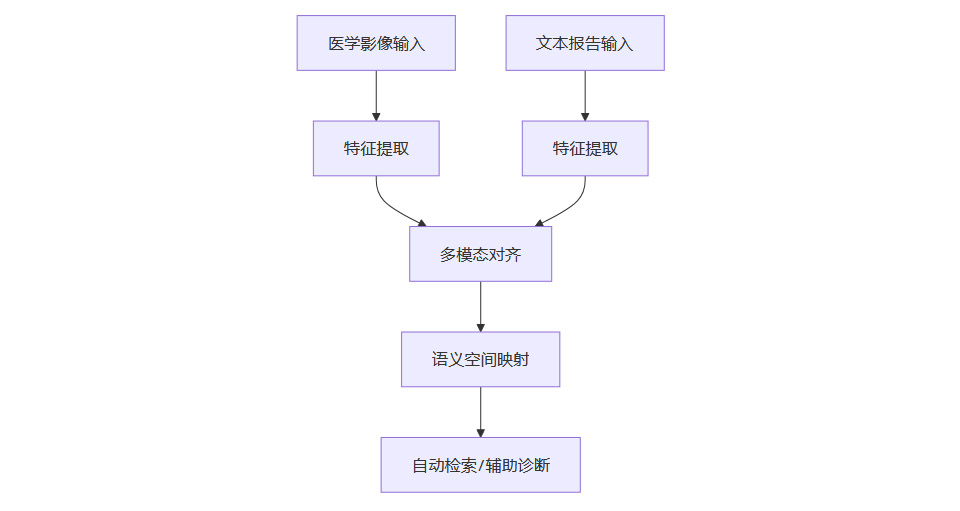
2.2 多模态数据融合与辅助决策
2.2.1 全面病情分析
多模态大模型能够融合患者的临床文本、影像、实验室检查和基因组信息,实现更全面的病情分析。例如,肺部感染性疾病的诊断中,模型通过整合CT影像与临床症状、实验室指标,实现了高精度的病原体识别和分类。
2.2.2 基因-影像联合分析
通过将基因组数据与影像特征联合建模,模型可预测肿瘤的分子分型、药物敏感性等,为个体化治疗提供科学依据。例如,乳腺癌的分子分型预测,结合影像和基因数据,准确率显著提升。
2.2.3 辅助决策流程表
2.3 全病程预测与个性化医疗
2.3.1 时间序列建模与动态预测
多模态模型结合时间序列建模和基因组分析,实现疾病从筛查、诊断到预后的全流程预测。例如,融合CT、PET影像及基因数据可预测肿瘤进展风险并生成个性化治疗方案。
2.3.2 神经系统疾病的早期预测
在阿尔茨海默病等神经系统疾病中,结合MRI和fMRI数据,模型可提前3-5年预测疾病发展,为早期干预提供可能。
2.3.3 个性化医疗推荐
通过持续学习患者全病程数据,模型可为不同患者制定个性化诊疗和随访方案,实现精准医疗闭环。
2.4 辅助诊断、报告生成与手术规划
2.4.1 自动报告生成
多模态AI能够自动生成放射科报告,提升报告生成效率和准确性。例如,基于多模态输入的报告生成模型,准确率可达85%以上。
2.4.2 手术路径规划
在脑肿瘤等复杂手术中,多模态模型为手术提供高精度解剖结构支持,辅助医生进行路径规划,降低手术风险。
三、🔬多模态对齐技术提升诊断准确率的机制

3.1 多源数据互补与信息增益
3.1.1 互补性机制
影像数据:提供直观的病灶形态、位置、大小等信息。
文本数据:补充患者主诉、病史、症状描述等背景信息。
基因数据:揭示遗传风险、分子分型、药物敏感性等深层机制。
三者结合,极大减少误诊和漏诊,提升诊断的全面性和准确性。
3.1.2 信息增益流程
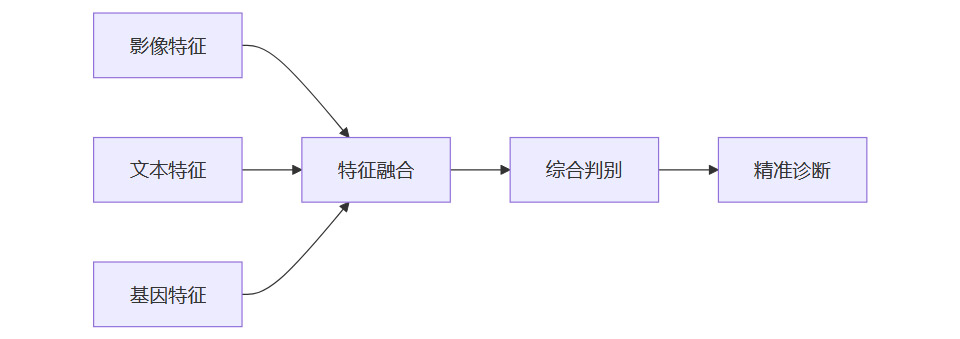
3.2 智能特征提取与自动化分析
3.2.1 微小病变识别
AI模型可自动识别影像中的微小病变,结合文本和基因信息,提升疾病识别的敏感性和特异性。例如,乳腺结节、脑膜瘤等疾病的早期筛查准确率显著提升。
3.2.2 自动化分析流程
数据预处理与标准化
多模态特征提取
特征对齐与融合
智能判别与结果输出
3.3 诊断一致性与自动化
3.3.1 一致性保障
AI系统不受人为主观影响,能保持诊断一致性,尤其在高难度、罕见病例中表现突出。
3.3.2 自动化诊断流程
自动数据采集与整合
智能特征提取与分析
诊断结果自动生成与推送
3.4 实时监测与预警
3.4.1 可穿戴设备与远程医疗
多模态AI结合可穿戴设备和远程医疗系统,实现对患者生理参数、影像变化的实时监测和早期预警,及时发现病情变化,辅助早期干预。
3.4.2 实时监测流程
数据实时采集
多模态特征融合
异常检测与预警
医生干预与随访
3.5 全流程闭环与个性化推荐
3.5.1 持续学习与闭环管理
通过持续学习患者全病程数据,AI系统能够为不同患者制定个性化的诊疗和随访方案,实现精准医疗闭环。
3.5.2 个性化推荐流程
全病程数据采集
多模态特征融合
个性化诊疗方案生成
智能随访与动态调整
四、🏥典型案例与产业落地
4.1 权威机构的创新实践
4.1.1 多模态病理与影像组学
中山大学附属第三医院、江苏省医学图像人工智能工程研究中心等权威机构,在多模态病理、影像组学、肿瘤影像基因组学等领域取得国际领先成果,推动了多模态AI在临床诊断中的广泛应用。
4.1.2 产业化应用平台
联影智能uAIVision:支持从术前规划到术后随访的全流程多模态数据整合与智能分析。
春雨医生“慧问AI家庭医生”:通过多模态输入输出能力优化,实现检查报告、图片等多源数据的智能识别与问诊,提升在线医疗服务的智能化和个性化水平。
4.2 科研突破与临床验证
4.2.1 多模态AI系统的临床应用
四川大学华西医院、清华大学DUCG智能医疗云平台等多模态AI系统,在肺部感染、肝癌、脑膜瘤等疾病诊断中展现出显著优势,部分系统在三甲医院测试准确率超95%。
4.2.2 典型案例表
4.3 产业落地的关键要素
4.3.1 数据标准化与互操作性
推动多模态数据的标准化、互操作性建设,是实现大规模产业落地的基础。各大平台正积极推动数据接口、标注规范、互联互通等标准体系建设。
4.3.2 临床验证与多中心协作
多模态大模型需通过大规模、多中心临床试验验证其泛化性和安全性,推动模型在不同医疗场景下的广泛应用。
4.3.3 轻量化部署与边缘计算
结合MobileNet-V2等轻量化模型,实现多模态AI在边缘计算、移动设备上的高效部署,推动AI下沉基层医疗,提升基层诊断能力。
4.4 典型应用流程与成效展示
多模态大模型在医疗诊断中的应用流程,通常包括数据采集、预处理、特征提取、对齐融合、智能判别、结果输出与反馈等环节。以下以流程图形式展示:

在实际应用中,这一流程不仅提升了诊断效率,还通过医生反馈不断优化模型性能,实现“人机协同”的智能医疗闭环。
五、⚡挑战与未来展望

5.1 数据与技术挑战
5.1.1 数据异构性与标准化
医疗数据来源广泛,设备、协议、格式各异,导致数据标准化难度大。不同医院、科室、设备采集的数据在分辨率、标注方式、存储格式等方面存在显著差异,影响模型的泛化能力和跨机构应用。
5.1.2 数据质量与规模
高质量、多样化的医疗数据是多模态大模型成功的基石。当前,数据采集、标注、清洗等环节仍面临诸多挑战,尤其是罕见病、特殊人群等数据稀缺,限制了模型的全面性和适应性。
5.1.3 模型可解释性
多模态大模型的决策过程往往呈现“黑箱”特性,难以获得医生和患者的完全信任。开发注意力可视化、特征溯源等可解释性工具,成为提升模型透明度和临床可用性的关键。
5.1.4 动态损失优化与特征融合
随着多模态数据的不断丰富,如何实现高效、动态的特征融合与损失优化,成为提升模型鲁棒性和诊断准确率的技术难题。BSAFusion、动态标签调整等新技术为模型优化提供了新思路。
5.2 伦理、隐私与合规
5.2.1 隐私保护
多模态数据融合涉及大量敏感健康信息,数据安全与隐私保护成为行业关注焦点。联邦学习、差分隐私等技术的应用,有效降低了数据泄露风险,保障了患者隐私。
5.2.2 可解释性与监管合规
医疗AI需具备可审核、可追溯、可信赖的特性,符合全球AI治理和医疗监管要求。模型开发与应用需严格遵循伦理规范,确保技术创新与社会责任并重。
5.3 临床转化与多学科协作
5.3.1 多中心验证
多模态大模型需通过大规模、多中心临床试验验证其泛化性和安全性。多中心协作不仅提升了模型的适应性,也为不同地区、不同人群的医疗服务提供了坚实保障。
5.3.2 跨学科协作
医学、计算机、统计、伦理等多学科协作,是多模态大模型开发、验证和优化的基础。多学科团队共同参与,有助于提升模型的科学性、实用性和可持续发展能力。
5.4 未来趋势
5.4.1 轻量化部署与边缘智能
随着移动医疗和远程医疗的普及,轻量化、多模态大模型将在边缘计算、移动设备等场景实现高效部署,推动AI下沉基层医疗,提升基层诊断能力和医疗服务均衡性。
5.4.2 全病程管理与智能随访
多模态大模型将进一步拓展至疾病全生命周期管理,包括早筛、诊断、治疗、康复、随访等环节,实现真正意义上的智能医疗闭环。通过持续学习和动态调整,模型可为患者提供全程、个性化的健康管理服务。
5.4.3 数据标准化与互操作性提升
行业将加快推动多模态数据的标准化、互操作性建设,制定统一的数据接口、标注规范和互联互通标准,促进数据共享与协同创新。
5.4.4 可解释性与伦理治理并重
未来多模态大模型将在提升可解释性、透明度的同时,强化伦理治理和合规监管,确保技术创新与社会责任协同发展。
六、🌟结论
多模态大模型正以前所未有的速度和深度,重构医疗诊断的全流程。通过跨文本、影像、基因等多源数据的深度融合,多模态对齐技术不仅显著提升了诊断的准确率和效率,还推动了医疗服务从单一模态分析迈向全病程智能管理。无论是在疾病早期筛查、精准诊断、个体化治疗,还是在全生命周期健康管理中,多模态大模型都展现出强大的技术潜力和广阔的应用前景。
尽管面临数据异构、标准化、隐私保护、可解释性等多重挑战,但随着技术进步、数据标准化、隐私保护和多学科协作的不断加强,多模态大模型有望实现更广泛的临床应用和产业落地,成为精准医疗和健康管理的重要支柱。未来,随着轻量化部署、全病程管理、数据标准化和伦理治理的持续推进,多模态大模型将在医疗智能化道路上持续引领创新,为“健康中国”战略和全球医疗创新发展注入强劲动力。
💬 【省心锐评】
多模态大模型让医疗诊断更智能、更精准,未来已来,落地才是硬道理。

.png)


评论