【摘要】谷歌与耶鲁大学联合发布的C2S-Scale 27B模型,通过创新的双情境虚拟筛选技术,从4000余种药物中识别出激酶CK2抑制剂silmitasertib。该药物与低剂量干扰素联用,能协同提升抗原呈递效率约50%,为“冷”肿瘤免疫治疗提供了全新策略。
引言
在与癌症的漫长博弈中,免疫疗法无疑是近十年来最耀眼的明星。它不再像传统化疗那样无差别攻击,而是巧妙地唤醒人体自身的免疫系统,让T细胞等免疫卫士去精准清除癌细胞。这种“借力打力”的思路,为无数患者带来了新生。
但是,免疫疗法并非万能神药。临床实践中,一个严峻的现实摆在面前,只有部分患者能从中获益。许多肿瘤天生就是伪装大师,它们把自己包裹得严严实实,让免疫系统“视而不见”。医学界给这类肿瘤起了一个形象的名字——“冷”肿瘤。它们内部缺乏免疫细胞浸润,像一座孤寂的冰山,对免疫疗法的呼唤毫无反应。
与之相对的,是那些能够被免疫系统有效识别和攻击的**“热”肿瘤**。两者的核心区别,很大程度上在于一个名为**“抗原呈递”**的关键生物学过程。简单来说,就是肿瘤细胞是否愿意将自己内部的“坏分子”特征(即肿瘤抗原)展示在细胞表面,供免疫细胞识别。如果这个过程受阻,肿瘤就成功“隐身”,免疫系统便无的放矢。
因此,如何将“冷”肿瘤转化为“热”肿瘤,点燃免疫反应的火焰,成了肿瘤免疫学领域最核心、也最棘手的挑战之一。传统的药物研发路径,依赖于海量的实验筛选和漫长的周期,面对肿瘤微环境的极端复杂性,常常显得力不从心。
现在,人工智能,特别是大规模语言模型,正以一种前所未有的方式切入这个难题。谷歌研究院与耶鲁大学的最新合作成果——C2S-Scale 27B模型,就为我们展示了这样一种可能。它不再是简单的数据分析工具,而是一个能够生成全新、可验证科学假说的“虚拟科学家”。通过在数字世界中模拟4000多种药物的复杂作用,它精准地锁定了一种能让“冷”肿瘤“热”起来的潜在策略。这不仅是一次药物发现的成功,更可能是一场科研范式的深刻变革。
🎯 一、冰山之下 “冷”肿瘤的免疫逃逸迷局
%20拷贝-fvoh.jpg)
要理解这项研究的突破性,我们必须先潜入“冰山”之下,看清“冷”肿瘤是如何巧妙地躲避免疫系统的追杀。这背后涉及一套精密而复杂的细胞生物学机制。
1.1 抗原呈递 免疫系统的“哨兵系统”
想象一下,我们的身体是一个国家,免疫系统是国家的军队和警察。癌细胞则是潜伏在国内的间谍。为了让警察能够识别出间谍,间谍需要佩戴某种特殊的、暴露身份的徽章。在细胞世界里,这个“徽章”就是肿瘤抗原,而负责将徽章展示出来的系统,就是抗原呈递机制。
这个过程主要依赖细胞表面的一类叫做主要组织相容性复合体(MHC)的分子。具体到癌细胞,主要是MHC-I类分子。
1.1.1 MHC-I类分子的工作流程
这个流程可以被比作一个细胞内部的“质检与展示”流水线。
内部抽检 细胞内的蛋白酶体像一个碎纸机,会不断降解细胞内的各种蛋白质,包括那些因癌变而产生的异常蛋白质。
打包运输 这些蛋白质碎片(即肽段,也就是潜在的肿瘤抗原)被转运进内质网。
装载展示 在内质网中,这些肽段被装载到新合成的MHC-I类分子上,形成“肽段-MHC-I复合物”。
呈递表面 这个复合物随后被运输到细胞膜表面,像一面旗帜一样展示给过往的免疫细胞,特别是细胞毒性T淋巴细胞(CTL)。
当CTL的“侦察兵”(T细胞受体,TCR)识别出这个异常的“徽章”后,便会启动攻击程序,精准地杀死这个癌细胞。
1.2 “冷”肿瘤的“隐身术”
“冷”肿瘤之所以“冷”,核心原因就是上述的抗原呈递流水线出了故障。它们通过多种方式破坏这个过程,实现免疫逃逸。
下调MHC-I表达 这是最直接的手段。肿瘤细胞通过基因突变或表观遗传修饰,直接减少MHC-I分子的生产。没有了展示台,再多的“徽章”也无法被看见。
破坏抗原加工 肿瘤细胞可以抑制蛋白酶体的活性,或者阻断肽段进入内质网的通道(如TAP转运体),从源头上减少了可供呈递的抗原数量。
免疫抑制微环境 肿瘤细胞还会分泌一些信号分子,如TGF-β,来抑制周围免疫细胞的活性,或者招募一些“叛变”的免疫细胞(如调节性T细胞),共同构建一个免疫抑制的肿瘤微环境(TME)。
1.3 干扰素信号通路 破冰的关键
在与肿瘤的斗争中,免疫系统也并非束手无策。它拥有一种强大的信号武器——干扰素(Interferon, IFN),特别是γ-干扰素(IFN-γ)。
IFN-γ由活化的T细胞等免疫细胞分泌,当它与肿瘤细胞表面的受体结合后,会启动一系列下游信号通路(主要是JAK-STAT通路),其效果如同给抗原呈递流水线“加电”和“扩产”。
提升产能 显著上调MHC-I分子以及抗原加工相关组件(如蛋白酶体亚基、TAP转运体)的基因表达。
增强信号 促进一系列干扰素刺激基因(ISGs)的表达,这些基因的产物能进一步放大免疫信号,吸引更多的免疫细胞前来。
所以,增强干扰素信号,是目前将“冷”肿瘤“加热”的主流策略之一。但是,直接给患者注射高剂量的干扰素会带来严重的副作用,且疗效有限。很多“冷”肿瘤所处的微环境,并非完全没有干扰素,而是处于一种**“低水平干扰素信号”**的尴尬状态。这种信号强度不足以有效启动抗原呈递,却又真实存在。
这就引出了本次研究的核心科学问题 如何找到一种药物,它本身不产生强烈刺激,但能像一个放大器一样,在“低水平干扰素信号”这个特定情境下,将微弱的信号放大,最终实现抗原呈递的显著提升? 这就是研究团队定义的**“条件性放大器”**。
🧬 二、AI的新角色 从数据分析到假说生成
面对如此复杂且“情境依赖”的科学问题,传统的研究方法显得捉襟见肘。而这,恰恰是大模型施展拳脚的舞台。谷歌和耶鲁的研究团队构建的C2S-Scale 27B模型,其设计思想本身就是一次范式革命。
2.1 C2S-Scale 27B模型的技术底座
C2S-Scale的核心是谷歌开源的Gemma模型系列。Gemma与声名显赫的Gemini模型共享技术和基础设施,但在设计上更侧重于开放性和特定任务的微调。拥有270亿参数的C2S-Scale,使其具备了处理和理解海量、高维生物学数据的强大能力。
它的一个关键理念是**“Cell2Sentence”**,即把复杂的单细胞基因表达谱数据,转化为模型可以理解的“句子”。每个“句子”描述了一个细胞在特定状态下的完整基因表达信息。通过学习海量的细胞“句子”,模型就能理解不同细胞类型、不同状态之间的复杂关系,以及药物干预会如何改变这些“句子”的语法和词汇。
2.2 创新的双情境虚拟筛选流程
这项研究最精妙的设计,在于其**双情境虚拟筛选(Dual-Context Virtual Screening)**流程。这个流程旨在模拟并区分药物在两种截然不同的生物学环境下的效果,从而精准找到我们需要的“条件性放大器”。
我们可以用一个流程图来清晰地展示这个过程。
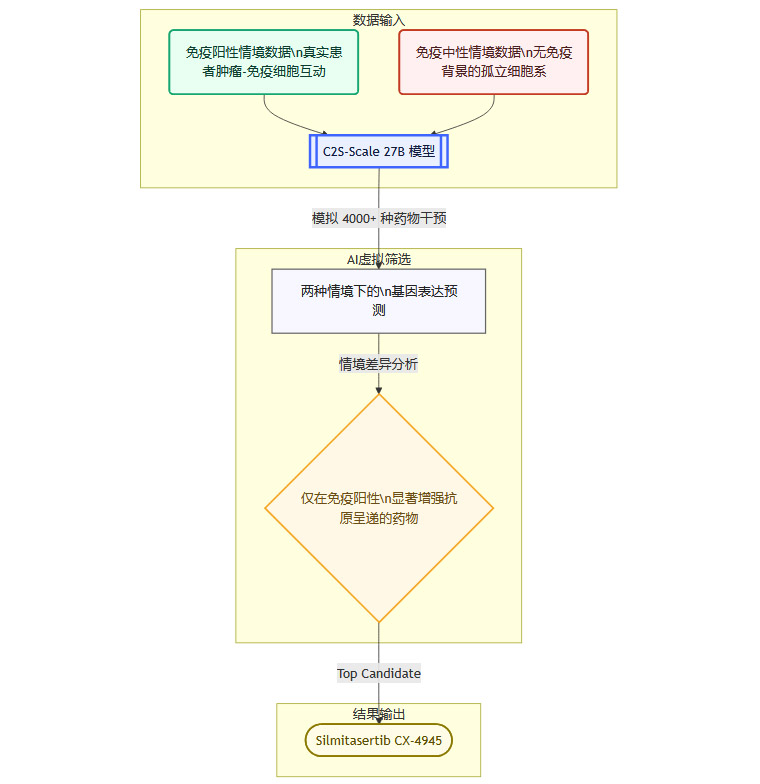
2.2.1 两种情境的深刻用意
免疫阳性情境 这部分数据源于真实世界,包含了肿瘤细胞与T细胞、巨噬细胞等各类免疫细胞相互作用的复杂信息。这代表了临床上“低水平干扰素信号”的真实微环境。模型在这里学习的是,在复杂的免疫网络中,药物如何发挥作用。
免疫中性情境 这部分数据来自实验室培养皿中的癌细胞,它们是“孤独”的,没有任何免疫细胞的干扰。这代表了一个干净的、无免疫背景的对照组。模型在这里学习的是,药物对癌细胞本身的直接影响。
通过对比药物在这两种情境下的预测效果差异,模型就能回答那个核心问题 哪些药物的效果是严重依赖于免疫微环境的?
2.3 高通量模拟与情境依赖性分析
C2S-Scale一次性对超过4000种已知药物进行了模拟。这种规模和速度是传统实验无法比拟的。更重要的是,它的分析维度是全新的。
传统的虚拟筛选,更多是基于药物的化学结构去预测其与靶蛋白的结合能力,这是一种**“结构-功能”的预测。而C2S-Scale进行的是“情境-功能”**的预测。它不只关心药物本身“能不能”,更关心它“在什么条件下能”。
这种情境依赖性分析是本次研究的灵魂。它让AI不再是一个简单的筛选器,而是一个能够理解复杂生物学逻辑的“思考者”。模型被训练去寻找一个特定的模式 在免疫中性情境下效应微弱,但在免疫阳性情境下能显著上调抗原呈递相关基因(如MHC-I类分子)的表达。
经过海量计算和比较,模型给出了一个异常清晰的答案。在4000多名“选手中”,一个名为**silmitasertib(CX-4945)**的药物脱颖而出,其预测的情境效应差异最为显著。AI的假说已经生成,接下来,就要看湿实验(wet lab)的验证了。
🔬 三、从硅基到碳基 AI假说的实验室惊艳验证
%20拷贝-sgmo.jpg)
一个由AI生成的假说,无论在计算上多么完美,如果不能被真实的生物学实验所证实,那它就只是空中楼阁。研究团队迅速将silmitasertib带入实验室,进行了一系列严谨的验证实验。实验结果不仅证实了AI的预测,甚至在某些方面超出了预期。
3.1 锁定目标 激酶CK2抑制剂Silmitasertib
在揭晓实验结果之前,我们先来认识一下这位被AI“选中”的主角。
药物名称 Silmitasertib,研发代号CX-4945。
作用靶点 它是一种高效、高选择性的**蛋白激酶CK2(Protein Kinase CK2)**的抑制剂。
CK2是什么? CK2是一种普遍存在于细胞中的丝氨酸/苏氨酸蛋白激酶,它像一个繁忙的“开关”,参与调控细胞增殖、存活、DNA修复等多种关键生命活动。在许多癌症中,CK2的活性都异常升高,因此它一直被视为一个有潜力的抗癌靶点。
虽然silmitasertib在多种癌症的临床前和早期临床研究中显示出一定的抗肿瘤活性,但从未有人系统地将其与“增强免疫微环境下的抗原呈递”这一功能联系起来。AI的发现,为这个“老药”赋予了全新的潜在用途。
3.2 协同效应的精妙验证
研究团队设计了一组精巧的细胞实验来验证AI的假说。他们使用的细胞是人类神经内分泌细胞,关键在于,这种细胞类型在模型的训练数据中从未出现过。这极大地考验了模型的泛化能力,即将其学到的知识应用到全新场景的能力。
实验设置模拟了“低水平干扰素信号”的环境,即使用低剂量的IFN-γ处理细胞。
实验结果清晰地展示了1+1>2的协同效应,具体数据如下表所示
这个结果堪称惊艳。它完美地印证了AI的预测 Silmitasertib正是一个“条件性放大器”。它自己不会唱主角,但当舞台上有一点微弱的音乐(低剂量IFN-γ)时,它能瞬间将音量调到最大,让抗原呈递这场“大戏”得以精彩上演。
约50%的提升是一个非常显著的生物学效应。这意味着,在联合用药的条件下,肿瘤细胞表面展示的“身份徽章”数量大幅增加,它们被免疫系统识别和清除的概率也随之大大提高。
3.3 机制的可解释性 AI不仅知其然,更知其所以然
更深层次的价值在于,AI的预测并非一个无法解释的“黑箱”。通过分析模型预测的基因表达变化,研究团队可以推断出其背后的作用机制。
模型的结果指向了一个清晰的、可供实验验证的机制假说 抑制CK2,可以增强细胞对IFN-γ信号的敏感性,从而放大下游的抗原呈递通路。
这个假说为后续的生物学研究指明了方向。科学家们可以进一步去探索,CK2究竟是如何“刹住”IFN-γ信号通路的?是影响了信号通路中某个关键蛋白的磷酸化,还是调控了某个抑制性分子的表达?
这种从“AI生成可验证假说”到“实验室证实并深入机制探索”的闭环,是AI驱动科学发现的理想范式。它将AI的计算能力与人类科学家的洞察力完美结合,极大地加速了从未知到已知的探索进程。
💊 四、从实验室到病床 临床转化的前景与蓝图
一项基础研究的成果,无论在细胞层面多么令人振奋,其最终的价值都体现在能否为患者带来真正的临床获益。Silmitasertib与低剂量干扰素的组合,为我们描绘了一幅充满希望的临床应用蓝图。这不仅仅是发现了一种新药组合,更是开创了一种新的治疗策略。
4.1 组合疗法 “增敏剂”的新角色
当前,免疫疗法的主力军是免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs),如PD-1/PD-L1抑制剂和CTLA-4抑制剂。它们的作用是解除免疫细胞(主要是T细胞)受到的“刹车”信号,让它们恢复攻击肿瘤的能力。
但是,对于“冷”肿瘤而言,即使解除了T细胞的刹车,问题依然存在。因为肿瘤微环境中根本就没有足够的T细胞,或者T细胞根本就识别不了肿瘤。这就像给一辆没有油的跑车松开了手刹,它依然无法前进。
而**“CK2抑制剂 + 低剂量干扰素”这个组合,恰好扮演了“加油”的角色。它的核心作用是增加肿瘤的免疫原性**,让肿瘤变得“可见”,从而吸引T细胞前来浸润和识别。
因此,一个极具潜力的临床应用场景浮出水面。
临床组合策略设想
这种组合策略,有望让那些原本对ICI治疗无效的“冷”肿瘤患者,重新获得响应的机会,从而极大地拓展免疫疗法的受益人群。
4.2 患者分层 精准医疗的导航图
任何一种强大的疗法,都需要精准地找到最适合它的患者群体。AI的发现,同样为我们提供了精准医疗的线索。这个新组合最有可能在哪类患者身上奏效?
答案就隐藏在“条件性放大器”的定义中。最理想的候选患者,其肿瘤微环境应该具备以下特征 存在低水平的干扰素信号,但该信号尚不足以有效诱导抗原呈递。
这为开发伴随诊断(Companion Diagnostics)提供了明确的方向。通过检测肿瘤组织中的特定生物标志物,我们或许可以筛选出“最优响应人群”。
潜在的生物标志物(Biomarkers)
基因表达签名
检测MHC-I类分子及抗原加工呈递通路(APM)相关基因(如TAP1, TAP2, PSMB8, PSMB9)的基础表达水平。
分析干扰素刺激基因(ISGs)的表达谱,寻找那些“低度激活”的患者。
蛋白水平检测
通过免疫组化(IHC)检测肿瘤细胞表面MHC-I的表达量。
检测CK2激酶及其下游信号通路的蛋白活性状态。
免疫细胞浸润
分析肿瘤组织中CD8+ T细胞的浸润密度和空间分布。低浸润的“冷”肿瘤是该策略的主要目标。
通过这些生物标志物的组合分析,医生可以在治疗前对患者进行精准分层,将这个强大的“武器”用在最需要的“战场”上,从而实现疗效最大化和资源最优配置。
4.3 广阔的应用场景
虽然最初的验证是在神经内分泌细胞上完成的,但考虑到CK2和干扰素信号通路的普遍性,这一策略的潜在应用范围非常广泛。
多种实体瘤 黑色素瘤、非小细胞肺癌、肾癌、头颈癌等,这些瘤种中都存在大量对ICI无响应的“冷”肿瘤患者。
血液肿瘤 某些类型的淋巴瘤或白血病,同样存在免疫逃逸和抗原呈递缺陷的问题。
克服耐药性 对于那些最初对ICI有效,但后来产生继发性耐药的患者,其耐药机制之一可能就是抗原呈递通路的下调。该组合有望逆转这种耐药,让治疗重获生机。
🤔 五、冷静的审视 挑战与未来之路
%20拷贝-rqfx.jpg)
从一个激动人心的实验室发现,到真正安全有效地应用于临床,中间还有一条漫长且充满挑战的道路要走。我们必须以严谨和审慎的态度,看待这项研究的局限性,并规划未来的探索方向。
5.1 从体外到体内的鸿沟
目前所有的验证工作,都还停留在细胞层面(in vitro)。细胞培养皿中的环境,与生物体内的复杂动态环境相去甚远。
动物模型验证 下一步的关键,是在**动物模型(in vivo)**中重复和验证这一发现。需要在荷瘤小鼠模型上评估该组合疗法的抗肿瘤效果,观察其是否真的能促进T细胞浸润,并将“冷”肿瘤“加热”。
药代动力学与药效学(PK/PD) 在活体中,药物的吸收、分布、代谢和排泄过程会极大地影响其效果。需要研究silmitasertib和干扰素在肿瘤组织中的浓度、作用时间,以及如何优化给药剂量和时序,以达到最佳的协同效应。
5.2 安全性与毒副作用的考量
任何药物都具有两面性。虽然我们期待它们的疗效,但必须警惕其潜在的毒性。
系统性副作用 干扰素本身就以其流感样症状、骨髓抑制等副作用而闻名。CK2作为一个参与多种细胞基础功能的核心激酶,长期抑制它可能带来难以预料的脱靶效应。组合用药是否会放大各自的毒性,是临床前安全性评估的重中之重。
免疫相关不良事件(irAEs) 过度激活免疫系统,可能导致免疫细胞攻击正常组织,引发自身免疫性疾病,如皮疹、结肠炎、肺炎等。在动物模型和未来的I期临床试验中,需要密切监测这些免疫毒性信号。
5.3 肿瘤异质性的挑战
“癌症”并非一种病,而是数百种疾病的集合。即使是同一种癌症,不同患者之间,甚至同一个患者体内的不同肿瘤病灶之间,都存在巨大的异质性。
肿瘤类型差异 不同类型的肿瘤,其免疫逃逸的主要机制可能不同。有些可能主要是MHC-I下调,有些则可能是免疫抑制细胞的招募。该组合策略对于不同机制主导的“冷”肿瘤,效果可能会有显著差异。
个体化差异 患者的遗传背景、免疫状态、肠道微生物等因素,都会影响其对治疗的反应。未来的研究需要更精细化的分层,找到最适合的肿瘤亚型和患者群体。
5.4 机制的复杂性
虽然我们有了一个清晰的机制假说,但生物体的真实情况远比模型复杂。
多通路协同 成功的免疫反应,不仅需要抗原呈递,还需要T细胞的有效浸润、存活和激活,以及一个支持性的免疫代谢环境。仅仅增强抗原呈递这一环,是否足以撬动整个免疫循环,还需要在更全面的维度上进行评估。
动态演化 肿瘤在治疗压力下会不断进化,产生新的耐药机制。需要长期观察该组合疗法的疗效持久性,并研究其潜在的耐药机制。
未来研究方向的规划
💡 六、超越药物发现 范式革命的启示
这项研究的意义,远远超出了发现一个潜在的抗癌药物组合。它为我们揭示了AI在未来科学发现中扮演的新角色,以及它如何重塑我们对复杂生物系统的认知和干预方式。
6.1 “情境药理学”新范式的崛起
传统的药物发现,遵循的是“一个靶点,一种药物,一种疾病”的线性模式。而这项研究则开启了**“情境药理学(Contextual Pharmacology)”**的大门。
大模型强大的学习能力,使得药物发现的焦点从预测药物与靶点的静态结合,转向了预测药物在特定生物学情境(如真实免疫情境)下的动态和差异化效应。这是一种认知上的升维。它承认并利用了生物系统的复杂性和非线性,致力于寻找那些能在“正确的时间、正确的地点”发挥作用的“智能”药物。
这为精准医学提供了前所未有的强大工具。未来,我们或许可以为每一个患者的独特肿瘤微环境,通过AI虚拟筛选,“定制”出最适合他的“条件性放大器”药物组合。
6.2 开源精神 加速科学创新
谷歌选择将C2S-Scale模型和相关方法开源,这一举动本身就极具价值。
加速多中心验证 全球各地的研究者都可以利用这个模型,在自己的数据集上进行验证和测试,这大大加快了科学共识的形成。
促进可复现研究 开源确保了研究的透明度和可复现性,这是科学进步的基石。
缩短研发周期 其他研究团队可以直接站在巨人的肩膀上,将这个模型应用于新的药物筛选或机制探索,避免了从零开始构建模型的巨大投入,从而将更多精力聚焦于解决核心的生物学问题。
6.3 通用框架的可迁移性
“条件性放大器”的思路,绝不仅限于癌症免疫治疗。许多疾病的发生发展,都具有强烈的**“情境依赖性”**。
感染性疾病 在病毒感染早期,机体处于“低水平免疫应答”状态。是否可以找到一种药物,在此时放大抗病毒信号,将感染扼杀在摇篮中?
自身免疫性疾病 在疾病的缓解期,免疫系统处于一种不稳定的平衡状态。是否可以找到一种药物,在特定炎性信号出现时,选择性地放大抑制性免疫信号,防止疾病复发?
神经退行性疾病 在阿尔茨海默病早期,大脑微环境中存在低度的神经炎症。是否可以找到一种药物,条件性地增强小胶质细胞的清除功能,延缓疾病进程?
C2S-Scale所代表的这种“双情境虚拟筛选”框架,为解决这些不同领域的难题,提供了一个通用的、可迁移的思考范式和技术路径。
总结
谷歌与耶鲁的这项合作,是AI与生命科学深度融合的又一个华彩乐章。它始于一个棘手的临床挑战——如何唤醒“冷”肿瘤的免疫原性。借助拥有270亿参数的C2S-Scale模型和创新的双情境虚拟筛选设计,研究团队在超过4000种药物的茫茫大海中,精准地“捕捞”出silmitasertib这一“条件性放大器”。
随后的实验室验证,不仅证实了AI假说的准确性,更揭示了其与低剂量干扰素联用时能够产生约50%的协同增效。这为开发全新的癌症免疫组合疗法提供了坚实的科学依据和可操作的起点。
更重要的是,这项工作展示了一种全新的科学发现范式。AI不再仅仅是处理数据的工具,它已经进化为能够洞察复杂生物学逻辑、生成全新、可验证科学假说的“灵感引擎”和“虚拟合作者”。
当然,从细胞实验的惊艳一瞥,到临床应用的漫漫长路,依然充满未知与挑战。但无论如何,一扇新的大门已经被推开。门后,是AI驱动的精准医疗和情境药理学更加广阔的未来。这条路,值得我们满怀期待地走下去。
📢💻 【省心锐评】
AI正从“解释过去”进化为“预测未来”。这次它不仅找到了潜在药物,更给出了使用说明书。这是计算能力向科学洞察力的一次质变。

.png)
%20%E6%8B%B7%E8%B4%9D-ciqf.jpg)

评论